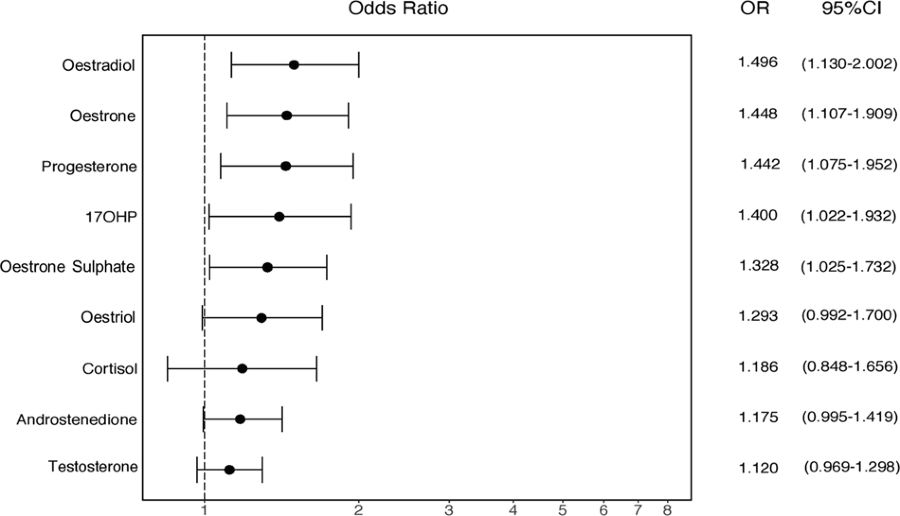
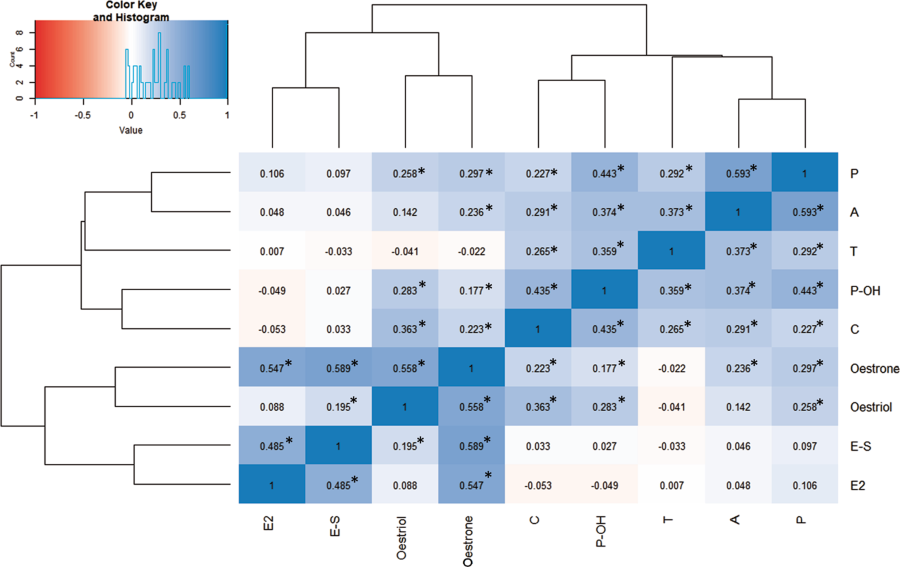
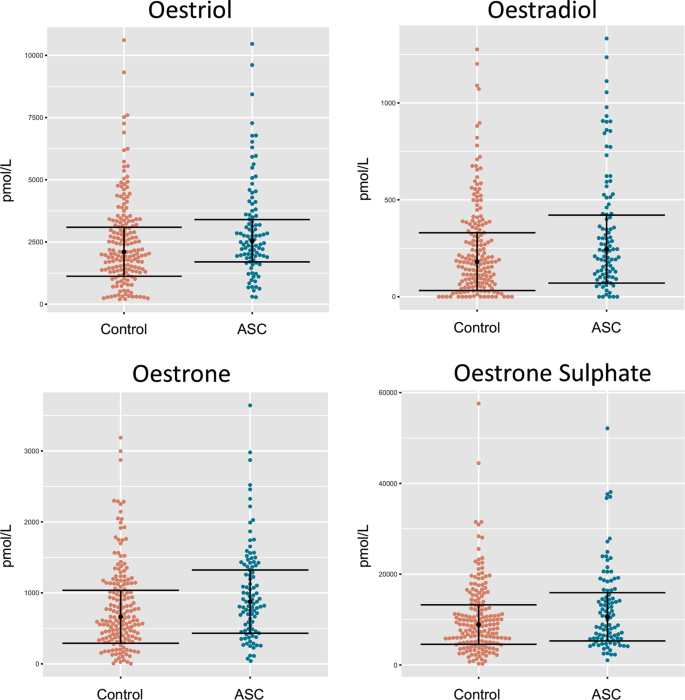
- 1.
Fombonne E. Epidemiology of pervasive developmental disorders. Pediatr Res. 2009;65:591–8.
- 2.
Baron-Cohen
S, Lombardo MV, Auyeung B, Ashwin E, Chakrabarti B, Knickmeyer R. Why
are autism spectrum conditions more prevalent in males? PLoS Biol.
2011;9:e1001081.
- 3.
Robinson
EB, Lichtenstein P, Anckarsäter H, Happé F, Ronald A. Examining and
interpreting the female protective effect against autistic behavior.
Proc Natl Acad Sci USA. 2013;110:5258–62.
- 4.
Jacquemont
S, Coe BP, Hersch M, Duyzend MH, Krumm N, Bergmann S, et al. A higher
mutational burden in females supports a “female protective model” in
neurodevelopmental disorders. Am J Hum Genet. 2014;94:415–25.
- 5.
Werling
DM, Geschwind DH. Recurrence rates provide evidence for
sex-differential, familial genetic liability for autism spectrum
disorders in multiplex families and twins. Mol Autism. 2015;6:1–14.
- 6.
Loomes
R, Hull L, Mandy WPL. What is the male-to-female ratio in autism
spectrum disorder? a systematic review and meta-analysis. J Am Acad
Child Adolesc Psychiatry]. 2017;56:466–74.
- 7.
Lai
MC, Lombardo MV, Suckling J, Ruigrok AN, Chakrabarti B, Ecker C, et al.
Biological sex affects the neurobiology of autism. Brain. 2013;136(Pt
9):2799–815.
- 8.
Floris
DL, Lai MC, Nath T, Milham MP, Di Martino A. Network-specific sex
differentiation of intrinsic brain function in males with autism. Mol
Autism. 2018;9:17.
- 9.
Baron-Cohen
S, Cassidy S, Auyeung B, Allison C, Achoukhi M, Robertson S, et al.
Attenuation of typical sex differences in 800 adults with autism vs.
3,900 controls. PLoS ONE. 2014;9:e102251.
- 10.
Greenberg
DM, Warrier V, Allison C, Baron-Cohen S. Testing the
empathizing-systemizing theory of sex differences and the extreme male
brain theory of autism in half a million people. Proc Natl Acad Sci USA.
2018;115:12152–7.
- 11.
Schwarz
E, Guest PC, Rahmoune H, Wang L, Levin Y, Ingudomnukul E, et al.
Sex-specific serum biomarker patterns in adults with Asperger’s
syndrome. Mol Psychiatry. 2011;16:1213–20.
- 12.
Tan
DW, Gilani SZ, Maybery MT, Mian A, Hunt A, Walters M, et al.
Hypermasculinised facial morphology in boys and girls with Autism
Spectrum Disorder and its association with symptomatology. Sci Rep.
2017;7:9348.
- 13.
Hines M, Constantinescu M, Spencer D. Early androgen exposure and human gender development. Biol Sex Differ. 2015;6:3.
- 14.
Welsh M, Suzuki H, Yamada G. The Masculinization Programming Window. Endocr Dev. 2014;27:17–27.
- 15.
Baron-Cohen
S, Auyeung B, Nørgaard-Pedersen B, Hougaard DM, Abdallah MW, Melgaard
L, et al. Elevated fetal steroidogenic activity in autism. Mol
Psychiatry. 2015;20:369–76.
- 16.
Kosidou
K, Dalman C, Widman L, Arver S, Lee BK, Magnusson C, et al. Maternal
polycystic ovary syndrome and the risk of autism spectrum disorders in
the offspring: a population-based nationwide study in Sweden. Mol
Psychiatry. 2016;21:1441–8.
- 17.
Berni
TR, Morgan CL, Berni ER, Rees DA. Polycystic ovary syndrome is
associated with adverse mental health and neurodevelopmental outcomes. J
Clin Endocrinol Metab. 2018;103:2116–25.
- 18.
Cherskov
A, Pohl A, Allison C, Zhang H, Payne RA, Baron-Cohen S. Polycystic
ovary syndrome and autism: a test of the prenatal sex steroid theory.
Transl Psychiatry. 2018;8:136.
- 19.
Manning JT, Baron-Cohen S, Wheelwright S, Sanders G. The 2nd to 4th digit ratio and autism. Dev Med Child Neurol. 2001;43:160–4.
- 20.
Ingudomnukul
E, Baron-Cohen S, Wheelwright S, Knickmeyer R. Elevated rates of
testosterone-related disorders in women with autism spectrum conditions.
Horm Behav]. 2007;51:597–604.
- 21.
Whitehouse
AJ, Mattes E, Maybery MT, Dissanayake C, Sawyer M, Jones RM, et al.
Perinatal testosterone exposure and autistic-like traits in the general
population: a longitudinal pregnancy-cohort study. J Neurodev Disord.
2012;4:25.
- 22.
Kung
KT, Constantinescu M, Browne WV, Noorderhaven RM, Hines M. No
relationship between early postnatal testosterone concentrations and
autistic traits in 18 to 30-month-old children. Mol Autism. 2016;7:15.
- 23.
Kung
KT, Spencer D, Pasterski V, Neufeld S, Glover V, O’Connor TG, et al. No
relationship between prenatal androgen exposure and autistic traits:
convergent evidence from studies of children with congenital adrenal
hyperplasia and of amniotic testosterone concentrations in typically
developing children. J Child Psychol Psychiatry. 2016;57:1455–62.
- 24.
McCarthy MM. Estradiol and the developing brain. Physiol Rev. 2008;88:91–134.
- 25.
Konkle
ATM, McCarthy MM. Developmental time course of estradiol, testosterone,
and dihydrotestosterone levels in discrete regions of male and female
rat brain. Endocrinology 2011;152:223–35.
- 26.
MacLusky NJ, Naftolin F. Sexual differentiation of the central nervous system. Science. 1981;211:1294–302.
- 27.
González
M, Cabrera-Socorro A, Pérez-García CG, Fraser JD, López FJ, Alonso R,
et al. Distribution patterns of estrogen receptor alpha and beta in the
human cortex and hippocampus during development and adulthood. J Comp
Neurol. 2007;503:790–802.
- 28.
Nunez
JL, Aberdeen GW, Albrecht ED, McCarthy MM. Impact of estradiol on
gamma-aminobutyric acid- and glutamate-mediated calcium responses of
fetal baboon (Papio anubis) hippocampal and cortical neurons.
Endocrinology 2008;149:6433–43.
- 29.
Durand
CM, Perroy J, Loll F, Perrais D, Fagni L, Bourgeron T, et al. SHANK3
mutations identified in autism lead to modification of dendritic spine
morphology via an actin-dependent mechanism. Mol Psychiatry.
2012;17:71–84.
- 30.
Li
J, Shi M, Ma Z, Zhao S, Euskirchen G, Ziskin J, et al. Integrated
systems analysis reveals a molecular network underlying autism spectrum
disorders. Mol Syst Biol. 2014;10:774.
- 31.
Puts
NAJ, Wodka EL, Harris AD, Crocetti D, Tommerdahl M, Mostofsky SH, et
al. Reduced GABA and altered somatosensory function in children with
autism spectrum disorder. Autism Res. 2017;10:608–19.
- 32.
Windham
GC, Lyall K, Anderson M, Kharrazi M. Autism spectrum disorder risk in
relation to maternal mid-pregnancy serum hormone and protein markers
from prenatal screening in California. J Autism Dev Disord.
2016;46:478–88.
- 33.
Tache
V, Baer RJ, Currier RJ, Li CS, Towner D, Waetjen LE, et al.
Population-based biomarker screening and the development of severe
preeclampsia in California. Am J Obstet Gynecol. 2014;211:377.e1–377.e8.
- 34.
Talge
NM, Holzman C, Senagore PK, Klebanoff M, Fisher R. Biological
indicators of the in-utero environment and their association with birth
weight for gestational age. J Dev Orig Health Dis. 2011;2:280–90.
- 35.
Walker
CK, Krakowiak P, Baker A, Hansen RL, Ozonoff S, Hertz-Picciotto I.
Preeclampsia, placental insufficiency, and autism spectrum disorder or
developmental delay. JAMA Pediatr. 2015;169:154.
- 36.
Moore
GS, Kneitel AW, Walker CK, Gilbert WM, Xing G. Autism risk in small-
and large-for-gestational-age infants. Am J Obstet Gynecol.
2012;206:314.e1–9.
- 37.
Lyall
K, Pauls DL, Spiegelman D, Ascherio A, Santangelo SL. Pregnancy
complications and obstetric suboptimality in association with autism
spectrum disorders in children of the Nurses’ Health Study II. Autism
Res. 2012;5:21–30.
- 38.
Faul
F, Erdfelder E, Buchner A, Lang A-G. Statistical power analyses using
G*Power 3.1: tests for correlation and regression analyses. Behav Res
Methods. 2009;41:1149–60.
- 39.
Weichman
BM, Notides AC. Estrogen receptor activation and the dissociation
kinetics of estradiol, estriol, and estrone. Endocrinology
1980;106:434–9.
- 40.
Korenman SG. Comparative binding affinity of estrogens. Steroids 1968;13:163–77.
- 41.
Sollberger S, Ehlert U. How to use and interpret hormone ratios. Psychoneuroendocrinology. 2016;63:385–97.
- 42.
van
de Beek C, Thijssen JH, Cohen-Kettenis PT, van Goozen SH, Buitelaar JK.
Relationships between sex hormones assessed in amniotic fluid, and
maternal and umbilical cord serum: what is the best source of
information to investigate the effects of fetal hormonal exposure? Horm
Behav. 2004;46:663–9.
- 43.
Kaludjerovic J, Ward WE. The Interplay between Estrogen and Fetal Adrenal Cortex. J Nutr Metab. 2012;2012:837901.
- 44.
Straughen
JK, Misra DP, Divine G, Shah R, Perez G, VanHorn S, et al. The
association between placental histopathology and autism spectrum
disorder. Placenta. 2017;57:183–8.
- 45.
Anderson
GM, Jacobs-Stannard A, Chawarska K, Volkmar FR, Kliman HJ. Placental
trophoblast inclusions in autism spectrum disorder. Biol Psychiatry.
2007;61:487–91.
- 46.
Park
BY, Misra DP, Moye J, Miller RK, Croen L, Fallin MD, et al. Placental
gross shape differences in a high autism risk cohort and the general
population. PLoS One. 2018;13:e0191276.
- 47.
Dachew
BA, Mamun A, Maravilla JC, Alati R. Pre-eclampsia and the risk of
autism-spectrum disorder in offspring: meta-analysis. Br J Psychiatry.
2018;212:142–7.
- 48.
Curran
EA, O’Keeffe GW, Looney AM, Moloney G, Hegarty SV, Murray DM, et al.
Exposure to hypertensive disorders of pregnancy increases the risk of
autism spectrum disorder in affected offspring. Mol Neurobiol.
2018;55:5557–64.
- 49.
Murji
A, Proctor LK, Paterson AD, Chitayat D, Weksberg R, Kingdom J. Male sex
bias in placental dysfunction. Am J Med Genet A. 2012;158A:779–83.
- 50.
Escobar
JC, Patel SS, Beshay VE, Suzuki T, Carr BR. The human placenta
expresses CYP17 and generates androgens de novo. J Clin Endocrinol
Metab. 2011;96:1385–92.
- 51.
Pitteloud
N, Dwyer AA, DeCruz S, Lee H, Boepple PA, Crowley WF Jr., et al.
Inhibition of luteinizing hormone secretion by testosterone in men
requires aromatization for its pituitary but not its hypothalamic
effects: evidence from the tandem study of normal and
gonadotropin-releasing hormone-deficient men. J Clin Endocrinol Metab .
2008;93:784–91.
- 52.
Chakrabarti
B, Dudbridge F, Kent L, Wheelwright S, Hill-Cawthorne G, Allison C, et
al. Genes related to sex steroids, neural growth, and social-emotional
behavior are associated with autistic traits, empathy, and Asperger
syndrome. Autism Res. 2009;2:157–77.
- 53.
Sarachana
T, Hu VW. Genome-wide identification of transcriptional targets of RORA
reveals direct regulation of multiple genes associated with autism
spectrum disorder. Mol Autism. 2013;4:14.
- 54.
Simpson
ER, Mahendroo MS, Means GD, Kilgore MW, Corbin CJ, Mendelson CR.
Tissue-specific promoters regulate aromatase cytochrome P450 expression.
Clin Chem. 1993;39:317–24.
- 55.
Srivastava
DP, Woolfrey KM, Liu F, Brandon NJ, Penzes P. Estrogen receptor beta
activity modulates synaptic signaling and structure. J Neurosci.
2010;30:13454–60.
- 56.
Hoffman
JF, Wright CL, McCarthy MM. A critical period in purkinje cell
development is mediated by local estradiol synthesis, disrupted by
inflammation, and has enduring consequences only for males. J Neurosci.
2016;36:10039–49.
- 57.
Mukherjee
J, Cardarelli RA, Cantaut-Belarif Y, Deeb TZ, Srivastava DP, Tyagarajan
SK, et al. Estradiol modulates the efficacy of synaptic inhibition by
decreasing the dwell time of GABAA receptors at inhibitory synapses.
Proc Natl Acad Sci USA. 2017;114:11763–8.
- 58.
Ganguly
K, Schinder AF, Wong ST, Poo M. GABA itself promotes the developmental
switch of neuronal GABAergic responses from excitation to inhibition.
Cell. 2001;105:521–32.
- 59.
Sellers
KJ, Erli F, Raval P, Watson IA, Chen D, Srivastava DP. Rapid modulation
of synaptogenesis and spinogenesis by 17β-estradiol in primary cortical
neurons. Front Cell Neurosci. 2015;9:137.
- 60.
Rubenstein
JLR, Merzenich MM. Model of autism: increased ratio of
excitation/inhibition in key neural systems. Genes Brain Behav.
2003;2:255–67.
- 61.
Robertson
CE, Kravitz DJ, Freyberg J, Baron-Cohen S, Baker CI. Slower rate of
binocular rivalry in autism. J Neurosci. 2013;33:16983–91.
- 62.
Robertson
CE, Kravitz DJ, Freyberg J, Baron-Cohen S, Baker CI. Tunnel vision:
sharper gradient of spatial attention in autism. J Neurosci.
2013;33:6776–81.
- 63.
Hensch TK. Critical period plasticity in local cortical circuits. Nat Rev Neurosci. 2005;6:877–88.
- 64.
Rochira V, Carani C. Aromatase deficiency in men: a clinical perspective. Nat Rev Endocrinol. 2009;5:559–68.
- 65.
Chen
Z, Wang O, Nie M, Elison K, Zhou D, Li M, et al. Aromatase deficiency
in a Chinese adult man caused by novel compound heterozygous CYP19A1
mutations: effects of estrogen replacement therapy on the bone, lipid,
liver and glucose metabolism. Mol Cell Endocrinol. 2015;399:32–42.
- 66.
Bejerot
S, Eriksson JM, Bonde S, Carlstrom K, Humble MB, Eriksson E. The
extreme male brain revisited: gender coherence in adults with autism
spectrum disorder. Br J Psychiatry. 2012;201:116–23.
- 67.
Lu
S-F, Mo Q, Hu S, Garippa C, Simon NG. Dehydroepiandrosterone
upregulates neural androgen receptor level and transcriptional activity.
J Neurobiol. 2003;57:163–71.
- 68.
Yeh
S, Miyamoto H, Shima H, Chang C. From estrogen to androgen receptor: A
new pathway for sex hormones in prostate. Proc Natl Acad Sci USA.
1998;95:5527.
- 69.
Pohl
A, Cassidy S, Auyeung B, Baron-Cohen S. Uncovering steroidopathy in
women with autism: a latent class analysis. Mol Autism. 2014;5:27.
- 70.
Auyeung
B, Taylor K, Hackett G, Baron-Cohen S. Foetal testosterone and autistic
traits in 18 to 24-month-old children. Mol Autism. 2010;1:11.
- 71.
Lauritsen
MB, Jørgensen M, Madsen KM, Lemcke S, Toft S, Grove J, et al. Validity
of childhood autism in the Danish Psychiatric Central Register: findings
from a cohort sample born 1990-1999. J Autism Dev Disord.
2010;40:139–48.
- 72.
Underwood MA, Gilbert WM, Sherman MP. Amniotic fluid: not just fetal urine anymore. J Perinatol 2005;25:341–8.